電動勢(或電極電勢)的數值與電池反應(或半反應式)的寫法無關,而平衡常數的數值隨反應式的寫法(即化學計量數不同)而變。()
 搜題
搜題
第2題
電動勢E(或電極電勢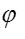 )的數值與電池反應(或半反應式)的寫法無關,而平衡常數
)的數值與電池反應(或半反應式)的寫法無關,而平衡常數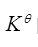 的數值隨反應式的寫法(即化學計量數不同)而變。( )
的數值隨反應式的寫法(即化學計量數不同)而變。( )
第5題
由標準鈷電極(Co2+/Co)與標準氯電極組成原電池,測得其電動勢為1.64V,此時鈷電極為負極。已知 (Cl2/Cl-)=1.36V。問:(1) 標準鈷電極的電極電勢為多少(不查表)?(2) 此電池反應的方向如何?(3) 當氯氣的壓力增大或減小時,原電池的電動勢將發生怎樣的變化?(4) 當Co2+的濃度降低到0.010mol·dm-3時,原電池的電動勢將發生怎樣的變化?數值是多少?
(Cl2/Cl-)=1.36V。問:(1) 標準鈷電極的電極電勢為多少(不查表)?(2) 此電池反應的方向如何?(3) 當氯氣的壓力增大或減小時,原電池的電動勢將發生怎樣的變化?(4) 當Co2+的濃度降低到0.010mol·dm-3時,原電池的電動勢將發生怎樣的變化?數值是多少?
第7題
A.電極反應中,增加氧化態物質的濃度。原電池的電動勢降低
B.#圖片0$#代數值較小的電對的氧化態物質也有可能軋化#圖片1$#代數值較大的電對中的還原態物質
C.原電池的電動勢越大,電池反應的反應速率越快
D.氧化還原反應進行的方向是氧化能力較強的氧化型物質氧化還原能力較弱的還原型物質
第8題
電動勢E(或電極電勢φ)的數值與反應式(或半反應式)的寫法無關,而標準平衡常數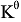 的數值隨反應式的寫法(即化學計量數不同)而變。 ( )
的數值隨反應式的寫法(即化學計量數不同)而變。 ( )
第9題
電動勢E(或電極電勢ψ)的數值與反應式(或半反應式)的寫法無關,而標準平衡常數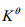 的數據,隨反應式的寫法(即化學計量數不同)而變。( )
的數據,隨反應式的寫法(即化學計量數不同)而變。( )
第10題
A.在一定溫度下稀釋電解質溶液,摩爾電導率Lm會增大,而電導率k會變小。
B.電極反應是可逆反應的電極不一定能測得平衡電勢。
C.對于給定的電極反應,標準電極電勢jy的數值隨溫度而變。
D.對任一種有液接的濃差電池,加鹽橋可以降低液接電勢,從而增加電動勢。