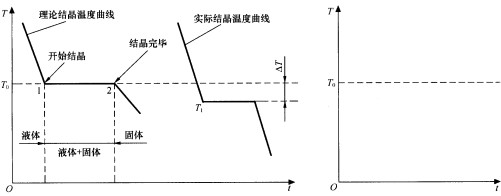
回答下列問題()
A.(1)金屬鐵是由(填原子、分子或 離子,下同)構成的,硫酸銅是由構成的
B.①當a=時,該微粒是原子
C.②當a=8時,該微粒是(填原子、陽離子或 陰離子),其符號為
D.(3)氯化氫是一種無色有刺激性氣味的氣體,走進實驗室就聞到了這種氣味。從分子的角度解釋這種現象
 搜題
搜題
第1題
(1)所標各部件中由金屬材料制成的是()(填字母),屬于有機合成材料的有()(任選一種部件填字母)。
(2)生鐵和鋼都是鐵的合金,其性能不同的原因是()。
(3)金屬礦物儲量有限,不可再生。保護金屬資源的有效途徑,除了防止金屬銹蝕外,還有()(寫一條即可)。
(4)將一定量的鋁、銅粉末混合物加入硝酸銀溶液中,充分反應后過濾,濾液為藍色。則濾渣中一定含有()(填化學式),濾液中溶質的組成可能是()或()(填化學式)。
第2題
右圖所示是液態二氧化碳滅火器,請回答下列問題。
(1)圖中所標物質中屬于金屬材料的是()(只寫一種),屬于有機材料的是________________(只寫一種)。
(2)加壓在小鋼瓶中液態二氧化碳噴出后能滅火。其原理是___________和______________。
(3)在鋼瓶表而涂油漆的作用是___________________。
(4)比較鐵和銅的金屬活動性強弱可采用的方法。

第3題
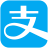
金屬在人類生活和生產中應用十分廣泛,下列是關于金屬的三組實驗,請回答下列問題。 (1)實驗Ⅰ中以“金屬表面產生氣泡的快慢”為標準來判斷鋅、鐵的活動性強弱,有同學認為該實驗設計不夠合理,理由是()。
(1)實驗Ⅰ中以“金屬表面產生氣泡的快慢”為標準來判斷鋅、鐵的活動性強弱,有同學認為該實驗設計不夠合理,理由是()。
(2)寫出實驗Ⅱ中C試管內反應的化學方程式()。
(3)實驗Ⅲ為實驗室模擬煉鐵的裝置圖。
①加熱Fe2O3之前要先通一會CO,目的是()。
②裝置末加酒精燈裝置的目的是()。
第4題
(1)電車外殼的鋼鐵部分噴涂油漆,它不僅美觀,還可以有效地防止鐵與()等物質接觸而生銹。
(2)電車軌道的主要材料是錳鋼,它屬于鐵的合金,其硬度比純鐵()。
(3)為了探究錳、鋅、鐵三種金屬活動性順序,某同學設計將錳塊、鋅粒和鐵塊分別放入質量和質量分數均相同的稀鹽酸中進行實驗,該同學實驗設計中的不足之處是();寫出鐵與鹽酸反應的化學方程式()。
第5題
回答下列問題: (1)在Fe3+的溶液中加入KNCS溶液時出現了血紅色,但加入少許鐵粉后,血紅色立即消失。 (2)在配制的FeSO4溶液中為什么需加一些金屬鐵? (3)為什么不能在水溶液中由Fe3+鹽和KI制得FeI3? (4)當Na2CO3溶液作用于FeCl3溶液時為什么得到的是氫氧化鐵,而不是Fe2(CO3)3? (5)變色硅膠含有什么成分?為什么干燥時呈藍色,吸水后變粉紅色? (6)為什么[CoF6]3-為順磁性,而[Co(CN)6]3-為抗磁性? (7)為什么[Fe(CN)6]3-為低自旋,而[FeF6]3-為高自旋? (8)為什么[Co(H2O)6]3+的穩定性比[Co(NH3)6]3+低得多(用晶體場理論解釋)? (9)為什么將FeO溶解在酸化的H2O2溶液中,與此同時會從溶液中放出氧氣?
第7題
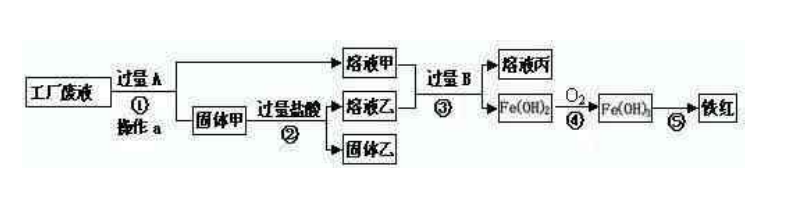
某工廠廢液中含有氯化鈉.氯化銅和氯化亞鐵。某課外小組要從廢液中回收銅并得到鐵紅(主要成分Fe2O3),要求全過程不引入其他金屬元素。設計實驗方案如下圖所示,
回答下列問題。
(1)加入過量A溶解后,再進行操作a時玻璃棒的作用是()。
(2)工廠廢液中加入過量A反應的化學方程式為()。
(3)溶液甲中的金屬離子是()(寫離子符號)。
(4)步驟①②③中所發生的化學反應,其中屬于置換反應的是()(填序號)。
(5)鐵紅是煉鐵的主要原料,寫出用CO和鐵紅煉鐵的化學方程式()。
第8題
回答下列問題。
(1)FeCl3溶液與Na2CO3溶液作用時為何生成的是氫氧化鐵沉淀,而不是碳酸鐵沉淀?
(2)Fe3+能腐蝕Cu,而Cu2+又能腐蝕Fe,兩者是否有矛盾?試應用有關的電極電勢說明之。
(3)實驗室使用鉑制器皿時,應遵守哪些操作規程,為什么?
(4)銅器在潮濕的空氣中放置會慢慢生成一層銅綠。
(5)討論:Cu(Ⅱ)和Cu(I)相互轉化的條件及其化合物的穩定性。
(6)在金屬焊接時,為何常用濃ZnCl2溶液處理金屬表面?
(7)汞與硝酸反應,當汞過量時為什么生成的是硝酸亞汞?
(8)指出Hg2+和Hg2+2性質上的差異,可用哪些反應來區別它們?
第9題
回答下列問題。
(1)FeCl3溶液與Na2CO3溶液作用時為何生成的是氫氧化鐵沉淀,而不是碳酸鐵沉淀?
(2)Fe3+能腐蝕Cu,而Cu2+又能腐蝕Fe,兩者是否有矛盾?試應用有關的電極電勢說明之。
(3)實驗室使用鉑制器皿時,應遵守哪些操作規程,為什么?
(4)銅器在潮濕的空氣中放置會慢慢生成一層銅綠。
(5)討論:Cu(Ⅱ)和Cu(I)相互轉化的條件及其化合物的穩定性。
(6)在金屬焊接時,為何常用濃ZnCl2溶液處理金屬表面? (7)汞與硝酸反應,當汞過量時為什么生成的是硝酸亞汞? (8)指出Hg2+和Hg2+2性
第10題
根據下圖,可以由重晶石(BaSO4)作為原料,制造金屬鋇及一些鋇的化合物。試回答下列問題:
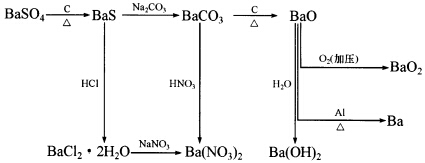 (1)現擬從重晶石制備BaCl2.2H2O。應該采用哪些步驟?寫出其化學方程式,并說明完成反應的理由。 (2)為何不能用BaS與硝酸作用直接制備Ba(NO3)2? (3)為何工業上不采用BaCO3直接加熱分解方法制備BaO?
(1)現擬從重晶石制備BaCl2.2H2O。應該采用哪些步驟?寫出其化學方程式,并說明完成反應的理由。 (2)為何不能用BaS與硝酸作用直接制備Ba(NO3)2? (3)為何工業上不采用BaCO3直接加熱分解方法制備BaO?
第11題
回答下列問題:
(1)化學反應的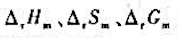 和電池電動勢及電極電勢值的大小,哪些與化學反應方程式的寫法無關?
和電池電動勢及電極電勢值的大小,哪些與化學反應方程式的寫法無關?
(2)為何H2S水溶液不能長期保存?
(3)能否用鐵制容器盛放CuSO4溶液?
(4)配制SnCl2溶液時,為防止Sn2+被空氣中氧所氧化,通常在溶液中加入少許Sn粒,為什么?
(5)鐵溶于過量鹽酸或過址稀硝酸,其氧化產物有何不同?
(6)為何金屬Ag不能從稀H2SO4或鹽酸中置換出H2,,卻能從氫碘酸(HI)中置換出H2?